


Kontrastmittel auf Gadoliniumbasis (GBCA) sind Arzneimittel, die intravenös verabreicht werden, um die Qualität der diagnostischen Bildgebungsverfahren der Magnetresonanztomographie (MRT) oder Magnetresonanzangiographie (MRA) zu verbessern. FDA-Warnungen zu möglichen Nebenwirkungen erhöhten die Bedenken von Patienten und Ärzten, auch neuere FDA-Informationen weisen darauf hin, dass ionisches Gadolinium aus GBCA freigesetzt werden kann, was möglicherweise eine Gadoliniumtoxizität verursacht. Bei den makrozyklischen GBCA scheint diese Wirkung deutlich geringer. Wir haben überprüft, ob und inwieweit Gadolinium nach Verabreichung von GBCA ohne Intervention renal ausgeschieden wird und ob und inwieweit Chelatbildner die Gd-Mobilisierung unterstützen. Durch Vergleichswerte unserer internen Datenbank mit internationalen Studienergebnissen kamen wir zu dem Schluss, dass derzeit kein klarer Konsens besteht. Während DTPA und möglicherweise EDTA die Gd-Bindung und Ausscheidung möglicherweise fördern, sind kaum Forschungsarbeiten vorhanden, die dies bestätigen. Gezielte Studien sind erforderlich. Es scheint jedoch klar zu sein, dass mikrocyclische GBCA die Gadoliniumretention weniger fördern und somit ein geringeres Risiko für eine Gadoliniumtoxizität darstellen. Patienten sollten somit über die Art des verabreichten GBCA informiert werden.
Das erste gadoliniumhaltige Kontrastmittel war Magnevist® (Gadopentetat-Dimeglumin). Dieses lineare GBCA wurde 1981 synthetisiert und 1988 von der FDA (Food and Drug Administration) für den klinischen Einsatz zugelassen. Magnevist® wurde bevorzugt verabreicht, weltweit fast 100 Millionen Mal. In Deutschland wurde die Nutzung dieses GBCA aufgrund möglicher Nebenwirkungen eingeschränkt. Weitere elf (11) GBCA wurden von der FDA zugelassen. (Clough 2019)
Laut FDA sind „Gadolinium-basierte Kontrastmittel (GBCA) intravenös verabreichte Arzneimittel, die in diagnostischen Bildgebungsverfahren zur Verbesserung der Qualität der Magnetresonanztomographie (MRT) oder Magnetresonanzangiographie (MRA) eingesetzt werden“. Die FDA und andere Behörden berichten außerdem, dass die Verwendung von GBCA ein gewisses Risiko in sich birgt, einschließlich allergischer Reaktionen. (Chen 2011)
Forscher haben darauf hingewiesen, dass das Toxizitätsrisiko durch ungebundene Gadoliniumionen verringert wird, sobald Gadolinium eine entsprechende chemische Verbindung eingeht. Die Verwendung dieser Verbindungen birgt dennoch ein gewisses Toxizitätsrisiko in sich. (Do 2020) Diesbezüglich veröffentlichte die FDA eine Stellungsnahme am 27. Juli 2017: „Die Bewertung des Risikos von Gehirnablagerungen bei wiederholter Verwendung von Kontrastmitteln auf Gadoliniumbasis“.
Am 16.05.2018 aktualisierte die FDA diese Informationen und erklärte: „Alle MRT-Zentren sollten einen Medikationsleitfaden bereitstellen, sobald ein ambulanter Patient zum ersten Mal eine GBCA-Injektion erhält oder wenn Informationen wesentlich geändert werden. Im Allgemeinen müssen stationäre Krankenhauspatienten keinen Medikationsleitfaden erhalten, es sei denn, Patient oder die Pflegeperson fordern dies an. Medizinisches Fachpersonal, das feststellt, dass es nicht im besten Interesse eines Patienten ist, einen Medikationsleitfaden zu erhalten, weil erhebliche Bedenken hinsichtlich seiner Auswirkungen bestehen, kann anweisen, dass diese Information dem Patienten nicht zur Verfügung gestellt wird. Der Medikationsleitfaden sollte jedoch jedem Patienten zur Verfügung gestellt werden, der die Informationen anfordert. “ https://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/201277Orig1s000SumR.pdf
Nach Angaben der Europäischen Arzneimittel-Agentur und der Bundesanstalt für Arzneimittel und Medizinprodukte (Januar 2018) sind die langfristigen Risiken der Verabreichung von Gadolinium-Kontrastmitteln unbekannt. Infolgedessen wurden in Deutschland 2018 die Suspension bestimmter Gadolinium-haltiger Kontrastmittel für die Magnetresonanztomographie (MRT) empfohlen. Die Bundesanstalt für Arzneimittel und Medizinprodukte (Bfarm) verlängerte diese Suspension bestimmter GBCA bis zum 28. Februar 2022.
In den USA gibt es derzeit keine Einschränkungen. Dr.med.Janet Woodcock, Direktorin des FDA-Zentrums für Arzneimittelbewertung und -forschung, erklärte: "Die FDA wird die Sicherheit von GBCA weiterhin bewerten. Zu diesem Zweck fordern wir die GBCA-Hersteller auf, weitere Studien durchzuführen, um die Sicherheit dieser Kontrastmittel zu bewerten. " (FDA 16.03.2008)
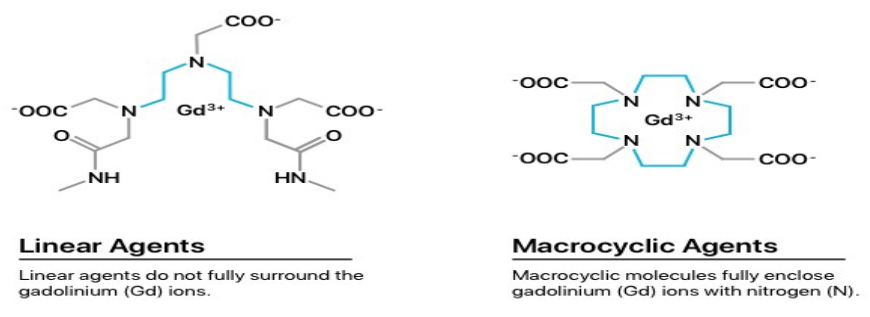
Gadolinium (III) -Komplexe werden seit Jahrzehnten als Magnetresonanztomographie (MRT) Kontrastmittel eingesetzt. Wie Clough und Kollegen betonten, haben sich Bedenken hinsichtlich ihrer Toxizität entwickelt, die vermutlich auf die Demetallierung der Komplexe in vivo zurückzuführen sind, zudem relativ große Mengen einer Verbindung für einen erfolgreichen Scan erforderlich sind. Die Stabilität von GBCA ist daher von großer Bedeutung und diese wird durch die Molekülstruktur der Verbindung bestimmt.
Entsprechend ihrer chemischen Struktur werden die Gd-haltigen Kontrastmittel in ionische und nichtionische, makrocyclische und lineare Kontrastmittel unterteilt. Die cyclische Struktur schafft eine starke Bindung an Gadolinium. Im Gegensatz weisen die linearen Kontrastmittel, die sogenannten Gd-Chelate mit offenen, beweglichen Ketten eine weniger starke Bindung an das toxische Gd3 + -Ion auf. (Hemsen 2012, Marckmann 2006)
Die linearen GBCA sind bei Patienten mit eingeschränkter Nierenfunktion kontraindiziert. Die Überprüfung der renalen Funktion nimmt somit eine zentrale Stellung ein. Wie von Dr. Lucie Yang in der Überprüfung des FDA Medical Team Leader dargelegt, wurden große Anstrengungen unternommen, um nach den charakteristischen Merkmalen der GBCA zu suchen, die dazu beitragen können, das Risiko einer nephrogenen systemischen Erkrankung vorherzusagen. (FDA 2011)
Die Toxizität des freien Gd3 + -Ions hängt mit zwei Eigenschaften zusammen: seiner Unlöslichkeit bei physiologischem pH-Wert, was zu einer sehr langsamen systemischen Ausscheidung führt; und einem Ionenradius nahe dem von Ca2 +, der es Gd3 + ermöglicht, biologisch mit Ca2 + zu konkurrieren.
Ramalho und Kollegen fassten die Literatur zu GBCA im Zusammenhang mit Tier- und Humanstudien zusammen, insbesondere Informationen zur Stabilität der Wirkstoffe. In dem Artikel „Akkumulation und Toxizität von Kontrastmitteln auf Gadoliniumbasis: Ein Update“ betonen die Forscher, dass GBCA mit geringer Stabilität am häufigsten mit der Ablagerung von Gadolinium im Gehirn in Verbindung gebracht werden, so die Literatur seit 2014. (Ramalho 2015)
Ionisches Gadolinium ist bereits in sehr geringer Konzentration ein bekannter Blocker vieler spannungsgesteuerter Calciumkanäle. Es kann physiologische Prozesse wie die Kontraktionen der Skelett- und Herzmuskulatur, die Übertragung von Nervenimpulsen, sowie die Blutgerinnung hemmen. Ionisches Gadolinium hemmt auch die Mitochondrienfunktion, die Aktivität bestimmter Enzyme, einiger Dehydrogenasen und Kinasen sowie Glutathion-STransferasen und kann die Expression einiger Zytokine erhöhen und oxidativen Stress induzieren.
Spencer et al. berichteten, dass die einmalige Verabreichung von Gadoliniumchlorid bei Ratten Hauptläsionen verursachte, die in Zusammenhang gebracht werden konnten mit Mineralablagerung in Kapillarbetten, metallverursachter Phagozytose durch makrophagenähnliche Zellen, hepatozellulärer Nekrose und Milznekrose, gefolgt von verringerten Thrombozytenzahlen und erhöhten Gerinnungszeiten. Weitere Studien ergaben, dass Gadolinium ein starker Inhibitor des retikuloendothelialen Systems ist. (Williams 2016)
Während ionisches Gadolinium als hochtoxisch gilt, wurden GBCA als ungiftig eingestuft.
Nach Angaben der FDA gelten die GBCA mit den linearen oder Kettenliganden, insbesondere den nichtionischen, als am instabilsten und bergen das höchste Risiko, freies Gd freizusetzen, was zu Gadolinium-bedingten Toxizitätssymptomen und -erkrankungen führt. Die Stabilität der Chelatbildung zwischen dem Gadolinium-Ion und den Liganden ist entscheidend für die Risikoeinschätzung. Makrocyclische GBCA haben eine höhere Stabilitätskonstante als lineare.
GDD ist die Bezeichnung für einen neu beschriebenen, noch nicht allgemein akzeptierten Zustand der Gadolinium (Gd)‑Toxizität.
Die klassischen Symptome des neu postulierten, aber noch nicht bestätigten Zustands der Gadolinium-Ablagerungskrankheit (GDD) wurden beschrieben. Sie umfassen Gehirnnebel, Kopfschmerzen, verschwommenes Sehen und trockene Augen, brennende Hautschmerzen, Knochen- und / oder Gelenkschmerzen, Neuralgie und Hautverfärbungen, teigige oder verdickte Haut. (Ramalho 2017)
Im Jahr 2006 wurden Gadolinium-haltige Kontrastmittel erstmals als Ursache der Nephrogenen Systemischen Fibrose genannt (Agarwal 2009, Grobner 2006). NSF ist eine potenziell tödliche Krankheit, die zu einer Verhärtung und Verdickung der Haut und der inneren Organe führt. Bei Patienten mit fortgeschrittener Niereninsuffizienz wurden NSFSymptome innerhalb von Tagen bis Monaten nach Verabreichung von GBCA beobachtet. (Nephro-News, Ausgabe 1/08) Hobbs und Williams geben auf ihrer Website an, dass „festgestellt wurde, dass alle GBCA, auch Gadoliniumchlorid die Proliferation von Fibroblasten in Geweben von gesunden Probanden stimulieren und dass dies ein Hauptfaktor für die nephrogene systemische Fibrose sein kann, da die Proliferation von CD34 + -Fibroblasten das charakteristische histologische Merkmal dieser Krankheit ist. “ (Williams 2016)
Weitere gesundheitliche Auswirkungen sind Übelkeit, Kopfschmerzen, Schwindel, Gehirnnebel, Schmerzen in Haut, Knochen oder Gelenken. Die Schwere der Symptome scheint stark zu variieren. (Drugwatch, 2018)
NSF Symptome können nach einem Monat oder noch länger nach der GBCA Verabreichung auftreten. Die GDD-Symptome treten dagegen meist innerhalb eines Tages und ziemlich oft unmittelbar nach der Injektion auf, was entweder auf eine toxische oder eine immunologische Reaktion deutet.
Im Jahr 2019 beobachteten Semalka und Ramalho, dass viele der von GDD betroffenen Personen an einer Autoimmunerkrankung leiden. Die Autoren berichten, dass ihre „derzeitige Meinung ist, dass GDD viele Elemente des Immunsystems umfasst, einschließlich akuter humoraler Reaktion (Granulozyten, Mastzellen, B-Zellen), subakuter Reaktion (Makrophagen, T-Zellen) und chronischer Reaktion (zirkulierende Fibrozyten). ” GDD verläuft ähnlich mit einer Kombination aus akuten Überempfindlichkeitsreaktionen und NSF, was erklären könnte, weshalb alle GBCA unabhängig von ihrer Struktur GDD verursachen können, während NSF hauptsächlich mit weniger stabilen linearen Mitteln assoziiert ist. (Semalka 2019)
Source: Rogosnitzky, M., Branch S. Gadolinium-based contrast agent toxicity: a review of known and proposed mechanisms. Biometals.2016; 29:365-376
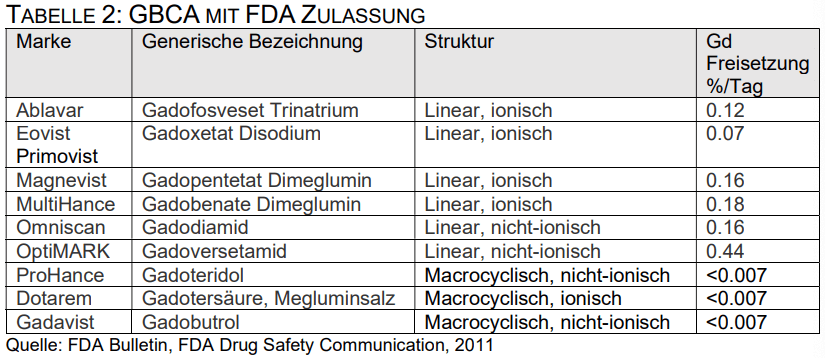
Tabelle 2 zeigt die von der US-amerikanischen Food and Drug Administration (FDA) zugelassenen GBCA. Die empfohlene Dosis beim Menschen beträgt 0,1 mmol / kg KG.
Im Jahr 2007 gab die FDA an, dass sie "bisher keine schädlichen Auswirkungen auf die Hirnretention von Kontrastmitteln auf Gadoliniumbasis für MRT" identifizieren konnte. In den folgenden Jahren haben Forscher wie Frenzel und andere diese Aussage durch Tierversuche widerlegt. (Jost 2019)
Im Jahr 2011 kehrte die FDA ihre frühere Ansicht um und stellte fest, dass „lineare GBCA zu einer deutlicheren Retention führen als makrocyclische GBCA. Die im Körper verbleibenden Gadoliniumspiegel sind nach Verabreichung von Omniscan (Gadodiamid) oder OptiMARK (Gadoversetamid) höher als nach Eovist (Gadoxetat-Dinatrium), Magnevist (GadopentetatDimeglumin) oder MultiHance (Gadobenat-Dimeglumin). Die Gadoliniumspiegel im Körper sind nach Verabreichung von Dotarem (Gadoterat-Meglumin), Gadavist (Gadobutrol) und ProHance (Gadoteridol) am niedrigsten. “
Raeschert und Kollegen bestätigten dies und stellten in einer Vergleichsstudie fest, dass im Gehirn von Ratten mit eingeschränkter Nierenfunktion Spuren von Dotarem (GadoteratMeglumin) nachgewiesen wurden, während in fast allen Hirnregionen nach Injektionen mit MultiHance (Gadobenat-Dimeglumin) und Omniscan (Gadodiamid) deutliche GdAblagerungen beobachtet wurden. (Raeschert 2018)
Die FDA dokumentierte, dass die prozentuale Menge an Gadolinium, die pro Tag freigesetzt wird, für das makrocyclische, ionische GBCA Dotarem und für die makrocyclischen nichtionischen GBCA ProHance und Gadavist vergleichsweise gering ist. (<0,007% / Tag). (Chen 2011)
In ihrer Übersicht stellen Chehabeddine und Kollegen fest, dass alle makrocyclischen GBCA weiterhin verwendet werden, „da keine verfügbaren gültigen Beweise sie mit der Gadoliniumretention im Gehirn in Verbindung bringen. Die Forscher geben auch an, dass „es bisher keine Beweise dafür gibt, dass die Gadoliniumretention bei Patienten mit normaler Nierenfunktion zu Krankheiten oder Störungen führt. Weitere Untersuchungen mit Langzeitstudien sind erforderlich. “ (Chehabeddine 2019)
In der Medizin wird die Chelat-Therapie zur Diagnose und Behandlung von Metallvergiftungen und chronischen Metallbelastungen eingesetzt. Dafür wird ein Chelatbildner verwendet, der Metallionen bindet. Die so entstandenen Metallchelate können dann vom Körper eliminiert werden. Somit werden derzeit Chelatbildner eingesetzt, um die Bindung und Eliminierung der im menschlichen Körper vorhandenen Gadoliniumablagerungen zu fördern. Eine zunehmende Anzahl von Ärzten betrachten die Chelatbildung als vielversprechende Therapie für Patienten, die möglicherweise unter GDD leiden.
Die molekulare Struktur jedes GBCA bestimmt seine Stabilität. Magnevist® ist ein linearer Molekülkomplex aus DTPA und ionischem Gadolinium. Laut dem Sicherheitsdatenblatt des Herstellers ist Magnevist® eine stabile Verbindung (Beyer Health Care Pharmaceuticals 2008); In der FDA-Veröffentlichung von 2011 wurde jedoch angegeben, dass Magnevist® Gadolinium mit einer Rate von 0,16% / Tag freisetzt und somit als nicht stabil eingestuft werden sollte. (Tabelle 2)

Chelatbildner, auch Chelatoren genannt, sind chemische Verbindungen, die mit Metallionen unter Bildung eines stabilen Komplexes reagieren. Diese Chelatbildner konkurrieren mit Körperliganden um Metalle. Aufgrund ihrer spezifischen Sulfhydryl-, Carboxyl- oder Hydroxylgruppen unterscheidet sich ihre Affinität zu Metallen.
DMPS (2,3-Bis (sulfanyl) propan-1-sulfonsäure) oder DMSA (Dimercaptobernsteinsäure) enthalten Sulfhydrylgruppen, die Metalle wie Arsen oder Quecksilber binden.
Die EDTAs (Ethylendiamintetraessigsäure) binden Metalle über Carboxylat- und Amingruppen und bilden mit Mn (II), Cu (II), Fe (III), Pb (II) und Co (III) Komplexe, indem sie das ihrem jeweiligen Molekül vorhandene Metall freisetzen, damit ein anderes (meist giftigeres) Metall aufgenommen und gebunden werden kann. So wird z.B. das Calcium des CaEDTAs freigesetzt, damit Blei gebunden werden kann. Es findet ein Austausch an Metallen statt.
Die DTPAs (Pentetinsäure oder Diethylentriaminpentaessigsäure) sind Komplexbildner aus der Gruppe der synthetischen Polyaminopolycarbonsäuren, die eine hohe Affinität für bestimmte Schwermetalle und Radionuklide aufweisen. Die Wirkung der DTPA Substanzen basiert ebenfalls auf einem Metallaustausch.
So wird bei der Anwendung von CaDTPA (Calciumtrinatriumdiethylentriaminpentaacetat) das Calciumion gegen ein Metallion ausgetauscht, das eine größere Bindungskonstante mit DTPA aufweist. Bei ZnDTPA (Zink-Diethylentriaminpentaacetat) wird das Zink-ion ebenfalls mit einem Metallion ausgetauscht, das eine größere Bindungskonstante mit DTPA aufweist. Die Ausscheidung des erzielten Metallchelatkomplexes erfolgt überwiegend über die Nieren. (Drisko 2018).
Somit funktionieren die EDTAs oder DTPAs durch Metallaustausch, während dies bei DMSA oder DMPS nicht der Fall ist. Letztere tauschen nicht aus, sie binden lediglich an vorhandene Strukturen.
Einige Forscher halten die EDTAs und DTPAs für potenzielle Gadolinium-Chelatoren Weinmann bemerkte allerdings, dass die Stabilitätskonstante für GdDTPA dagegen spricht. (Weinman 1984)
Allerdings, wird Gadolinium aus einer GBCA freigesetzt, wie in Tabelle 2 angegeben, steht freies Gadolinium zur Bindung zur Verfügung. Es besteht somit die Möglichkeit, dass DTPA und in geringerem Maße EDTA dieses freie Gadolinium bindet, damit der so entstandene Metallchelatkomplex renal ausgeschieden werden kann. Dies würde die Gadoliniumdekorporierung beschleunigen.
CaDTPA und ZnDTPA wurden seit über 40 Jahren in Medizin und Forschung eingesetzt. Welche der DTPAs jedoch besser für die Behandlung der Gadoliniumexposition geeignet sind, ist nicht ausreichend belegt. Für die Behandlung akuter interner Kontaminationen empfiehlt die FDA dass mit dem stärkeren Wirkstoff CaDTPA zu beginnen sei; mit ZnDTPA soll dann fortgefahren werden (FDA 2015).
Semalka und Kollegen berichteten in ihrer interim Studie (25 symptomatische Patienten mit Gadolinium-Ablagerungskrankheit), dass alle Patienten (18 Frauen; Durchschnittsalter 46,8 ± 15,3 Jahre) mindestens 1 Verabreichung eines Kontrastmittels auf Gadoliniumbasis erhalten hatten. Diese Patienten erhielten im Abstand von 1 Monat 15 Behandlungen und danach im Abstand von 1 Woche 10 Behandlungen.In allen Fällen bestand jede Behandlung aus einer Anwendung von jeweils Ca-DTPA und Zn-DTPA, die durch 24 Stunden getrennt waren. Es wurden Gd-Messungen des 24-Stunden-Urins vor und nach der Chelatbehandlung durchgeführt, wie auch am ersten und zweiten Therapietag. Die symptomatische Verbesserung der Patienten wurde unter Verwendung einer 10-Punkte-Skala von Patientensymptomen bestimmt.
Laut Semalka stieg der Gadoliniumgehalt im Urin während des monatlichen Regimes um das 30,3-fache an (P <0,001). Während des wöchentlichen Regimes wurde ein 12,9-facher Anstieg (P <0,001) verzeichnet. Insgesamt verbesserten sich die Symptome bei 13 Patienten, blieben unverändert bei 10 und verschlechterten sich bei 2. Bei den Symptomen Kopfschmerz, Gehirnnebel und Knochenschmerzen zeigte sich eine signifikante klinische Verbesserung während es monatlichen Regimes; Armschmerzen und Beinschmerzen reduzierten sich während des wöchentlichen Regimes. (Semalka 2018)
In einer Folgestudie, die 2019 veröffentlicht wurde, führten Semalka und Ramalho das Grundschema des Protokolls auf: CaDTPA-Tag 1, ZnDTPA-Tag 2, analog zu den Protokollen, die für die „Dekorporation“ radioaktiver Metalle verwendet wurden. Der Vorgang wurde wöchentlich oder monatlich für insgesamt drei Zeitpunkte der Chelatbehandlung wiederholt. Der Anstieg der Gd-Ausscheidung war nach CaDTPA am Tag 1 größer als mit ZnDTPA am Tag 2. Die Forscher stellten fest, dass selbst nach Anwendung makrocyclischer GBCA der Urinspiegel von Gd erhöht war, jedoch um weniger als die Hälfte des Anstiegs, der für alle anderen GBCA insgesamt beobachtet wurde. [Semalka 2018].
Prybylski und Kollegen konnten in ihrer Studie an Ratten nach wiederholter ZnDTPABehandlung keine Verringerung der Gd-Konzentration in einem Organ beobachten. Für diese Studie erhielten die Tiere 10 Dosen von 1 mmol / kg Gadodiamid intravenös injiziert und gleichzeitig oder nach 1, 4 oder 8 Stunden ZnDTPA (30 & mgr; mol / kg).Nach der Euthanisierung wurden die Gewebe drei Tage nach der letzten Dosis Gadodiamid entnommen und die Gd-Konzentrationen des Gewebes mittels ICP-MS Analytik bewertet. Zusätzlich wurde eine simulierte Gewebebehandlung mit einer einzelnen Dosis von 0,1 mmol / kg Gadopentetat mit 30 μmol / kg DTPA entweder gleichzeitig oder innerhalb der ersten 24 Stunden nach GBCA durchgeführt. (Prybylski 2019)
Boyken et al. beschrieben eine CaDTPA-Chelatbehandlung zur Gd-Entlastung bei Nagetieren. Die Tiere erhielten drei Infusionen von CaDTPA oder Kochsalzlösung einmal wöchentlich. Die Forscher beobachteten, dass bei den Nagetieren, die lineares GBCA (z. B. Gadopentetat; Magnevist) erhielten, die DTPA-Verabreichungen einen 10-fachen Anstieg von Gd im Urin erzielte. Parallel dazu nahm die Gd-Konzentration im Gehirngewebe ab. Im Gegensatz dazu mobilisierte CaDTPA kein Gd bei den Tieren, die makrocyclisches Gadobutrol erhielten, was darauf hinweist, dass Gadobutrol kein freies Gadolinium hinterließ. (Boyken 2019)
Greenberg berichtet, dass das Risiko einer Gadoliniumretention durch Verwendung zyklischer statt linearer GBCA verringert wird. Anhand eines Fallbeispiels zeigt er, dass „ein Patient mit chronischer Zinkvergiftung durch Anwendung einer Prothesencreme nach einem Magnetresonanztomographieverfahren Gadolinium zurückgehalten hat, wahrscheinlich aufgrund einer Transmetallierung. Während der Chelattherapie erhöhte sich der Gadoliniumspiegel im Urin (bis zu 89 μg / Tag, 29 Tage nach der Verabreichung von Gadolinium), was darauf hinweist, so Greenberg, dass Gadolinium zurückgehalten worden war. Fast 2½ Jahre nach der Gadolinium-Exposition zeigte eine 24-Stunden-Urinsammlung, dass der Gadoliniumspiegel noch immer im erhöhten Bereich lag (0,6 μg / Tag). Dieser Einzelfallbericht legt nahe, dass Patienten mit erhöhter Zinkexposition ein erhöhtes Risiko für eine Gadoliniumretention haben. “ (Greenberg 2010
Greenberg erwähnt nicht, dass die renale Gadoliniumausscheidung nach GBCA noch über längere Zeit ohne Intervention erfolgt.
Um Semalkas und weitere Forschungsergebnisse zu bestätigen, haben wir Urinproben ausgewertet, die MRT-Patienten zwischen 2007 und Mitte 2018 eingegangen waren. Jeder der Patienten hatte mindestens eine MRT erhalten. Welches GBCA, linear oder mikrozyklisch verabreicht wurde und zu welchem Zeitpunkt, war uns nicht bekannt.
Bei jedem der Probanden wurde der Urin vor und nach der Chelatbildung gesammelt und zwar am gleichen Tag. Wir verglichen die Gadoliniumkonzentration dieser Urinproben, die vor und nach der Chelatbildung entnommen worden waren.
Wir fanden keine Daten für Chelat-Behandlungen, die nur mit CaDTPA oder ZnDTPA durchgeführt wurden, lokalisierten jedoch zwei Patienten bei denen am gleichen Tag jeweils eine Urinprobe vor und nach der Chelattherapie mit DMPS + ZnDTPA entnommen worden war. Es ist zu erwähnen, dass bei der Kombinationstherapie DMPS + ZnDTPA diese beiden Chelatsubstanzen am selben Behandlungstag zeitnah verabreicht werden. Dieses Chelatprotokoll wurde von Dr. Peter VanderSchaar aus Leende, Niederlande, erstellt. Dabei wird DMPS (1 ml / min) in die Vene injiziert und nach 10 Minuten oder mehr wird ZnDTPA in dieselbe Vene verabreicht. Tabelle 6 zeigt, dass nach dieser Chelatbehandlung kein Anstieg der Gadoliniumausscheidung festgestellt werden konnte.

Es muss bemerkt werden, dass Semalkas Studien sich auf 24-Stunden-Urinsammlungen beziehen, d.h. die Gadoliniumkonzentration ist in µg / 24 h angegeben. Für diese Berechnung wird das 24h Probenvolumen benötigt.
Die Gadolinium-Messwerte in Tabelle 4-6 beziehen sich auf Kreatinin im Urin. Bei dieser Berechnung werden potenzielle Fehlerquoten verringert, die sich aus einem falschen Probenvolumen ergeben. Nach unserer Erfahrung ist das von Patienten- oder Arzthelfern bereitgestellte Probenvolumen selten korrekt. Somit ist es heute gang und gäbe, dass Urinmesswerte in mcg/g Kreatinin angegeben werden.
Semalkas Arbeit umfasste nur die Verabreichung von DTPA. Unsere Datenbank zeigte jedoch nur Testergebnisse für die Kombinationsbehandlung DTPA + DMPS. Um Fehler auszuschließen, verglichen wir auch die Basalurin- und Post-DMPS-Messwerte. Siehe Tabelle 5
In der 2008 veröffentlichten Produktmonographie Dimaval® listet Dr. Johann Ruprecht, Chemiker der Firma Heyl, Berlin die physikalisch-chemischen Parameter einer Reihe von Metallen auf. Der Autor berichtet über pharmakologische Experimente und Veröffentlichungen zur Bioverfügbarkeit von DMPS und seiner Metallbindungsfähigkeit. Gadolinium ist dieser Monographie nicht aufgeführt. Nach Angaben des Autors waren zu diesem Zeitpunkt keine entsprechenden Veröffentlichungen verfügbar. Dr. Ruprecht stellte auch fest, dass die Frage der GBCA-Sicherheit vor 2008 nicht aufgetaucht war. Erst nach 2014 zeigten Studien, dass Gadolinium im Gehirn abgelagert und zurückgehalten wird (Gulani 2017). Dr. Ruprecht vermutete, dass DMPS nicht mit Gadoliniumionen reagiert.
Für interne Forschungszwecke untersucht Micro Trace Minerals seit Jahren Gadolinium in Humanproben, vor allem im Urin vor und nach Chelattherapie. Wir haben daher Urindaten zu Gadolinium aus unserer Datenbank ausgewertet, um die Hypothese von Dr. Ruprecht zu beweisen oder zu widerlegen.
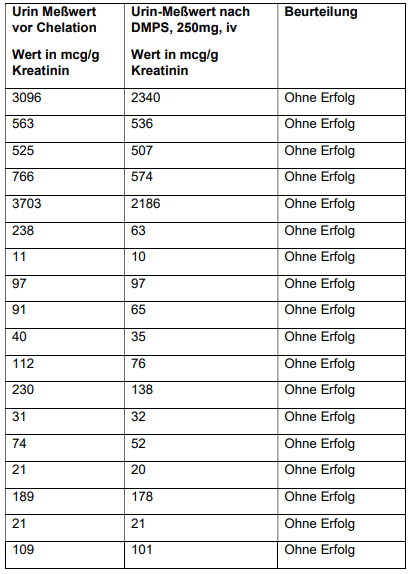
Tabelle 5 zeigt die Gadoliniumkonzentration im Urin, vor und nach der intravenösen Injektion einer Ampulle DMPS (250 mg). Von 25 Probenpaaren, bestehend aus Urin vor und nach der Chelatbildung, zeigte keines davon eine höhere Gadoliniumkonzentration nach der Chelatbildung. Die Aussage von Dr. Ruprecht wurde somit bestätigt.

In Deutschland verwenden immer mehr Chelat-Therapeuten die Kombinationsbehandlung
DMPS + CaEDTA. Der Grund für die Anwendung dieser Kombination ist die Annahme, dass die gleichzeitige Verabreichung von zwei starken, jedoch unterschiedlich wirkenden Chelatoren die Metallbindung und -eliminierung der unterschiedlichen Metalle erhöht. Bei diesem neuartigen Therapiekonzept handelt es sich um die zeitnahe Verabreichung zweier Chelatsubstanzen (DMPS plus CaEDTA). Man erhofft sich den „Two-for-One-Effekt“.
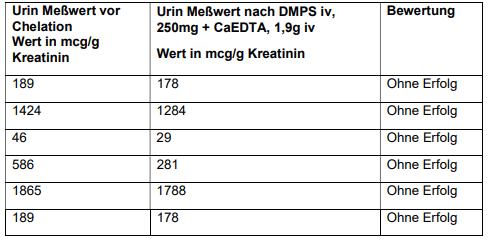
In unserer Datenbank haben wir nur sechs Patienten lokalisiert, bei denen vor der DMPS / Ca-EDTA-Mobilisierung Urin entnommen wurde. Tabelle 6 zeigt, dass in diesen Fällen die Gadoliniumausscheidung vor der Chelatbildung höher war.
BEWERTUNG DER URINKONZENTRATION VOR UND NACH CHELATION
Die Tabellen 4 bis 6 zeigen, dass die diagnostische Beurteilung von Gd im Urin den Vergleich von Messwerten vor und nach der Chelatbehandlung erfordert. Wird nur der Provokations- Messwert bewertet, führt dies zu einer Fehlinterpretation der Ergebnisse. Wenn zum Beispiel der Chelat-Therapeut seinen Behandlungsplan allein auf einen Provokationsurin-Messwert stützt, kann die Illusion eines „Erfolgs“ entstehen, obwohl die Gadolinium-Ausscheidung im Urin vor der Chelatbildung tatsächlich höher lag als nach Provokation, was bedeutet, dass die körpereigene Ausscheidungsfähigkeit effektiver als die medizinische Behandlung war.
GBCA verbleiben länger im Körper als bisher angenommen. Wir konnten nachweisen, dass Gadolinium auch ohne Anwendung von Chelatbildnern renal eliminiert wird und zwar über längere Zeit. Unsere Daten bestätigen auch, dass DMPS die Bindung und Ausscheidung von Gadolinium nicht beeinflusst. Dass die kombinierte Chelatbehandlung von CaEDTA oder ZnDTPA mit DMPS die Bindung und Ausscheidung von Gadolinium fördert, konnte aufgrund des Mangels an ausreichendem Probematerial nicht nachgewiesen werden.
Daten von Semalka und Kollegen legen nahe, dass die DTPAs Gadolinium nach GBCARetention „entgiften“. Andere Forscher konnten dies nicht bestätigen. Da die FDA bestätigte, dass die linearen GBCA das toxische Gadolinium-Ion freisetzen, scheint es wahrscheinlich, dass freies Gadolinium von den DTPAs und möglicherweise den EDTAs gebunden und renal eliminiert wird. Die Voraussetzung hierfür ist, so die Meinung der Autorin, dass jede dieser Chelatsubstanzen allein verabreicht wird.
Wir schlagen weitere und umfassendere Studien vor, wobei die Aufmerksamkeit auf das jeweilige GBCA-Produkt, (linear oder macrocylisch) gerichtet werden sollte, da dies der entscheidende Punkt bei der Entwicklung und Behandlung von GDD zu sein scheint. Ob die Notwendigkeit der Mono-Chelattherapie mit DTPA oder EDTA bei der Behandlung einer Gadoliniumretention gegeben ist, sollte verfolgt werden.
Clough TJ, Jiang L,, Wong KL, Long NJ. Ligand design strategies to increase stability of gadolinium-based magnetic resonance imaging contrast agents. Nat Commun. 2019; 10: 1420.
Dawson P, Semin Dial, Feb 1, 2008
Do C et al. Gadolinium-Based Contrast Agent Use, Their Safety, and Practice Evolution. Kidney360, 2020
Drugwatch. Llamas M. Gadolinium Side Effects. Oct 25, 2018
FDA. Questions and Answers on Calcium-DTPA and Zinc-DTPA (Updated 2015)
Greenberg SA. Zinc Transmetallation and Gadolinium Retention after MR Imaging: Case Report. Radiology 2010. 257(3)
Grobner T, Gadolinium – a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis? Nephrol Dial Transplant 2006. 21:1104-1108
Jost G, Frenzel T,Boyken J, Schoeckel L, Pietsch H. Gadolinium Presence in the brain after administration of the liver-specific gadolinium-based contrast agent Gadoxetate: A sytematik comparison to multipurpose agents in rats. Invest Radiol 2019 Aug;54(8):468-474.
Hemsen J, Einfluss der MR-Kontrastmittel MultiHance, Omniscan und Teslascan auf humane embryonale Lungenfibroblasten und humane Nabelschnurenendothelzellen. Dissertation zur Erlangung des Doktorgrades der Medizin. Med. Fakultät Erlangen 2012
Marckmann P. Skov L et al. Nephrogenic systemic fibrosis: suspected causative role of gadodiamide used for contrast-enhancing magnetic resonance imaging. J Am Soc Nephrol 2006. 17(9):2359-62
NCBI update 2020 https://pubchem.ncbi.nlm.nih.gov/compound/gadolinium
Prybylski JP, Sanchez CC, Jay M. Impact of chelation timing on gadolinium deposition in rats after contrast administration. Magnetic Resonance Imaging 2019. 55:140-144
Raeschert M et al. Gadolinium Retention, Brain T1 Hyperintensity, and Endogenous Metals: A Comparative Study of Macrocyclic Versus Linear Gadolinium Chelates in Renally Sensitized Rats. Invest Radiol 2018 Jun;53(6):328-337
Ramalho, J., Semelka, R. C., Ramalho, M., Nunes, R. H., AlObaidy, M., & Castillo, M. Review Article: Gadolinium-Based Contrast Agent Accumulation and Toxicity: An Update. AJNR Am J Neuroradiol,2015
Ramalho M, Ramalho J, Burke LM, et al. Gadolinium retention and toxicity—an update. Adv Chronic Kidney Dis. 2017;24:138–146.
Semelka RC, Commander CW, Jay M, et al. Presumed gadolinium toxicity in subjects with normal renal function: a report of 4 cases. Invest Radiol. 2016; 51: 661.
Semelka RC, Ramalho J, Vakharia A, et al. Gadolinium deposition disease: initial description of a disease that has been around for a while. Magn Reson Imaging. 2016;34:1383.
Semelka RC, Ramalho M, Jay M, Hickey L, Hickey. Intravenous Calcium- /ZincDiethylene Triamine Penta-Acetic Acid in Patients With Presumed Gadolinium Deposition Disease: A Preliminary Report on 25 Patients. Invest Radiol. 2018; 53: 373-.
Semelka RC, Ramalho M, The use of Ca-/Zn-DTPA for chelation of gadolinium in “Gadolinium Deposition Disease”.Diagnostic Imaging Europe. FEB/MARCH 2019.
aracteristics of gadolinium-DTPA complex: a potential NMR contrast agent. AJR Am J Roentgenol. 1984;142:619–624
Williams S, Hubbs G in https://gadoliniumtoxicity.com/2016/01/08/toxicity-ofgadolinium-deposition-from-mri-contrast-agents/ assessed 10 Sept 2010
Eleonore Blaurock-Busch MSc PhD
Leiterin des Arbeitskreises klinische Toxikologie
(Dieser Artikel ist eine Übersetzung des Artikels: Gadolinium In Medicine-An Evaluation and Update, erschienen im International Journal of Oncology Research and Therapy. 21. Sept. 2020)